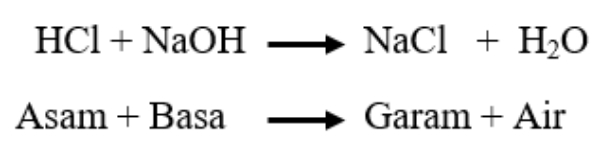
Menghitung pH campuran asam dan basa pada umumnya sama dengan menghitung pH larutan murni. Rumus umum pH larutan adalah : pH = – log [H+]. Kondisi yang membedakan perhitungan adalah adanya campuran asam dan basa, sehingga [H+] tiap larutan akan berbeda. Asam dan basa jika direaksikan akan menghasilkan garam dan air, dimana reaksi ini disebut dengan reaksi netralisasi. Adapun contoh reaksi netralisasi adalah sebagai berikut :
Adapun asam dan basa dapat dibagi menjadi dua, yaitu asam/basa kuat dan asam/basa lemah.
Oleh karena itulah, kondisi dari garam sendiri yang merupakan hasil reaksi asam dan basa terdapat 4 kemungkinan :
1. Asam Kuat dan Basa Kuat
2. Asam Kuat dan Basa Lemah
3. Asam Lemah dan Basa Kuat
4. Asam Lemah dan Basa Lemah
Untuk memperkuat pemahaman perhitungan pH campuran, maka kerjakan tugas berikut dan kumpulkan di Google Classroom :
1. Hitung pH larutan 100 mL HNO3 0,04 M dan 100 mL NH4OH 0,04 M ! (Kb NH4OH = 1,8 x 10-5)
2. Hitung pH larutan 50 mL HCOOH 0,02 M dan 50 mL KOH 0,01 M ! (Ka HCOOH = 1,8 x 10-4)
3. Hitung pH larutan 100 mL Asam asetat 0,05 M dan 100 mL hidroksilamina 0,05 M ! (Ka CH3COOH = 1,8 x 10-5 dan Kb NH2OH = 1,1 x 10-8)
Tuliskan reaksi lengkap beserta perhitungan stokiometri !