Seperti yang sudah kalian ketahui pada negara yang mempunyai empat musim, pada musim dingin suhu udara dapat mencapai -7 °C sedangkan pada musim panas mencapai 39 °C. Pada musim dingin, salju yang turun seringkali menutupi jalan raya sehingga untuk mengatasinya dilakukan penaburan garam agar salju melebur menjadi air. Selain itu, di beberapa negara di kawasan padang pasir untuk mendapatkan air tawar dilakukan desalinasi yaitu proses menghilangkan garam dari air laut. Kedua contoh di atas merupakan pemanfaatan sifat koligatif larutan. Lalu, apakah yang dimaksud dengan sifat koligatif larutan?
Sifat koligatif larutan adalah sifat larutan yang bergantung pada jumlah partikel zat terlarut dan tidak bergantung pada jenis zat terlarut. Pada pembahasan kali ini tujuan pembelajaran yang akan dicapai sebagai berikut:
- Menganalisis dan mendeskripsikan pengertian sifat koligatif larutan, yang meliputi penurunan tekanan uap (ΔP), kenaikan titik didih (ΔTb), penurunan titik beku (ΔTf), dan tekanan osmotik (π).
- Menganalisis hubungan antara penurunan tekanan uap (ΔP), kenaikan titik didih (ΔTb), penurunan titik beku (ΔTf), dan tekanan osmotik (π) dengan konsentrasi larutan.
- Menghitung tekanan uap larutan, titik didih larutan, titik beku larutan, dan tekanan osmotik larutan.
- Mendeskripsikan dan menemukan contoh penerapan sifat koligatif larutan dalam kehidupan sehari-hari.
Sifat koligatif larutan terdiri dari:
1. Penurunan tekanan uap (ΔP)
Jumlah uap di permukaan air murni lebih banyak daripada larutan, hal ini disebabkan terhalangnya pergerakan molekul air oleh partikel-partikel zat terlarut menyebabkan proses penguapan terganggu berakibat jumlah uap air di atas permukaan menjadi lebih sedikit dan tekanan uapnya akan turun. Besar penurunan tekanan uap air akibat adanya zat terlarut disebut penurunan tekanan uap larutan.
Menurut hukum Raoult besar tekanan uap larutan sebanding dengan fraksi mol pelarut (Xp) dan tekanan uap dari pelarut murninya(Pº).
2. Kenaikan titik didih (ΔTb)
Apabila suatu zat yang sukar menguap dilarutkan dalam air murni, maka pada suhu 100°C air belum mendidih. Diperlukan suhu yang lebih tinggi untuk dapat mendidih (tekanan uap air mencapai 1 atm). Besarnya kenaikan suhu disebut dengan kenaikan titik didih (ΔTb). Menurut Hukum Roult, besarnya kenaikan titik didih larutan (ΔTb) sebanding dengan tetapan kenaikan titik didih pelarut (Kb) dan molalitas larutan (m).
3. Penurunan titik beku (ΔTf)
Penurunan titik beku larutan (ΔTf) sebanding dengan hasil kali tetapan penurunan titik beku pelarut (Kf) dengan molalitas larutan (m).
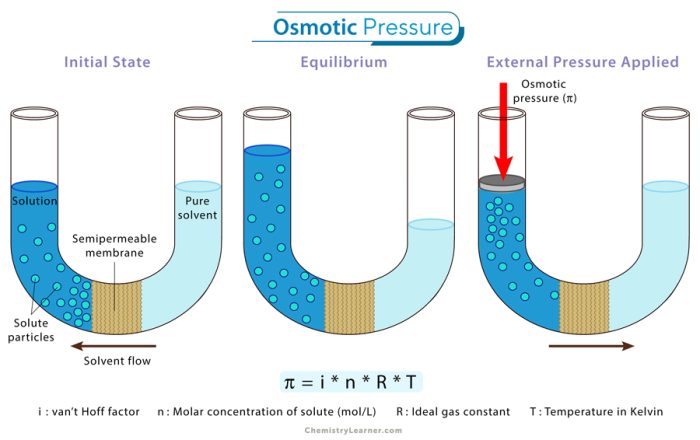
4. Tekanan osmotik (π)
Tekanan osmotik merupakan peristiwa bergeraknya partikel (molekul atau ion) melalui dinding semipermeabel. Molekul-molekul yang lebih kecil (pelarut) dari larutan yang berkonsentrasi rendah akan menerobos masuk melalui dinding semipermeabel untuk menuju ke larutan yang lebih pekat. Proses ini menyebabkan tekanan pada dinding semipermeabel yang disebut dengan tekanan osmotik.
Materi lebih lanjut silahkan klik link materi di bawah ini.
https://drive.google.com/file/d/1EAs80REGHlZTJVxuJBvz7kGdWlKjd4f8/view?usp=sharing